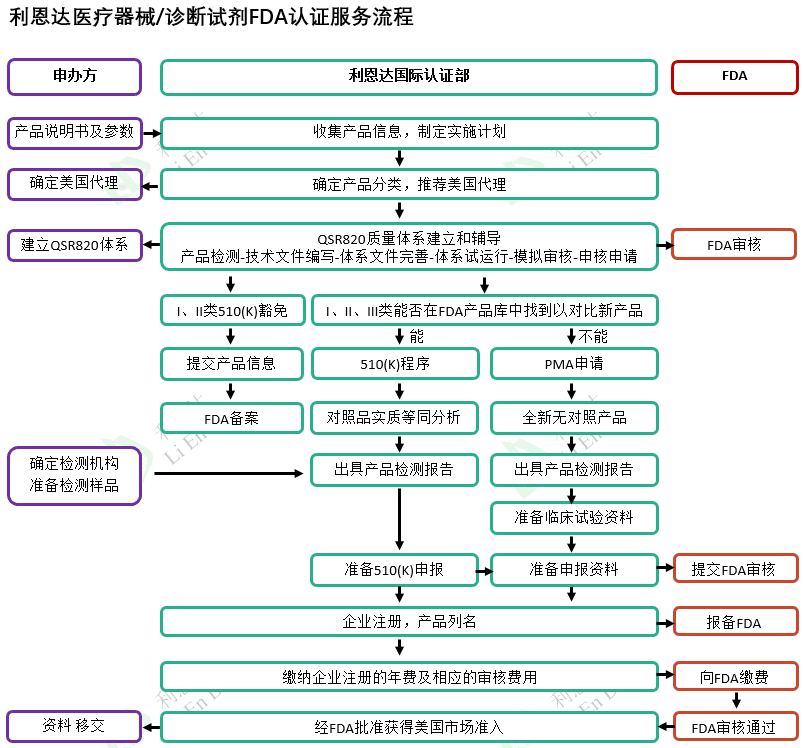
醫(yī)療器械産(chǎn)品在美國(guó)銷售,必須獲得美國(guó)FDA的批準,并在FDA完成企業和産(chǎn)品注冊登記。美國(guó)FDA對醫(yī)療器械實施了嚴格的分(fēn)類管控,全部II類和部分(fēn)I類醫(yī)療器械需要走上市前公(gōng)告程序(Pre-market Notification),也就是我們通常所說的510(k)程序。如果沒有(yǒu)對照産(chǎn)品則需要走PMA(Pre-market Approval)程序。
武漢利恩達醫(yī)療科(kē)技(jì )有(yǒu)服公(gōng)司會根據企業的具(jù)體(tǐ)情況及産(chǎn)品特征,幫助企業建立質(zhì)量體(tǐ)系、确定對照品、準備技(jì )術申報文(wén)件,并最終獲得美國(guó)FDA市場的準入資格。具(jù)體(tǐ)服務(wù)流程如下: