
各區(qū)市場監管局,房山(shān)區(qū)燕山(shān)市場監管分(fēn)局,市市場監管局機場分(fēn)局,經開區(qū)商(shāng)務(wù)金融局,市藥監局各分(fēn)局,各相關事業單位:
為(wèi)深入貫徹落實醫(yī)療器械生産(chǎn)監管相關法規要求,進一步規範北京市醫(yī)療器械生産(chǎn)監督檢查工(gōng)作(zuò),持續強化醫(yī)療器械生産(chǎn)科(kē)學(xué)監管,市藥監局組織對《聚合酶鏈反應(PCR)檢驗實驗室檢查要點指南(2016版)》進行了修訂,形成《北京市聚合酶鏈反應(PCR)檢驗實驗室檢查指南(2024版)》,現印發給你們,請參照執行。
特此通知。
北京市藥品監督管理(lǐ)局
2024年12月6日
北京市聚合酶鏈反應(PCR)檢驗實驗室檢查指南(2024版)
聚合酶鏈反應檢驗實驗室是指通過基因擴增的方式檢測特定的DNA或RNA的檢驗實驗室。聚合酶鏈反應(Polymerase Chain Reaction,PCR)是一種在體(tǐ)外特異性擴增靶DNA序列的技(jì )術,其基本過程為(wèi)模闆雙鏈DNA的變性、引物(wù)與模闆DNA的退火和在DNA聚合酶引導下的鏈延伸反應三個階段的多(duō)次循環。每一次循環後的擴增産(chǎn)物(wù)均可(kě)作(zuò)為(wèi)下一輪循環的模闆,理(lǐ)論上,擴增産(chǎn)物(wù)量呈指數形式上升,即經過n個循環後,産(chǎn)物(wù)量增加到2n倍,短時間内在體(tǐ)外可(kě)獲得數百萬個特異靶DNA序列的複制,為(wèi)預測、預防、診斷、治療監測、預後觀察和健康狀态評價提供了一種極有(yǒu)幫助的實驗室輔助手段。
PCR檢驗實驗室是PCR試劑生産(chǎn)企業在産(chǎn)品檢驗過程中(zhōng)不可(kě)缺少的工(gōng)作(zuò)環境,其環境控制水平和質(zhì)量管理(lǐ)水平直接影響着最終産(chǎn)品檢驗結果的準确性。由于該産(chǎn)品本身的特殊性,《醫(yī)療器械生産(chǎn)質(zhì)量管理(lǐ)規範附錄體(tǐ)外診斷試劑》、《醫(yī)療器械生産(chǎn)質(zhì)量管理(lǐ)規範體(tǐ)外診斷試劑現場檢查指導原則》條款中(zhōng),對PCR試劑的生産(chǎn)和檢驗環境做出明确規定。此外現行衛生行業的法規、标準以及相關文(wén)獻中(zhōng)對于PCR檢驗實驗室均作(zuò)出規定,主要涉及《全國(guó)臨床檢驗操作(zuò)規程》(第4版)、《醫(yī)療機構臨床基因擴增檢驗實驗室管理(lǐ)辦(bàn)法》(衛辦(bàn)醫(yī)政發〔2010〕194号)以及《實時熒光聚合酶鏈反應臨床實驗室 應用(yòng)指南》(WS/T 230-2024)等行業标準的相關要求。
本檢查指南旨在幫助北京市醫(yī)療器械監管人員增強對PCR檢驗相關過程的認知和把握,指導全市醫(yī)療器械監管人員對PCR檢驗實驗室設計建設與質(zhì)量控制的監督檢查工(gōng)作(zuò)。同時,為(wèi)PCR試劑生産(chǎn)企業在PCR檢驗實驗室的設計建造和管理(lǐ)要求提供參考。
本指南中(zhōng)涉及或引用(yòng)的國(guó)家相關法律、法規、規章、标準、檢查指南等發生内容或效力變化時,要以當時執行的最新(xīn)版為(wèi)準。必要時,北京市藥品監督管理(lǐ)局應重新(xīn)研究修訂,以确保本指南持續符合要求。
一、适用(yòng)範圍
本檢查指南可(kě)作(zuò)為(wèi)北京市藥品監督管理(lǐ)局組織、實施的體(tǐ)外診斷試劑産(chǎn)品注冊質(zhì)量管理(lǐ)體(tǐ)系現場核查、醫(yī)療器械生産(chǎn)許可(kě)現場核查、醫(yī)療器械生産(chǎn)監督檢查等涉及PCR檢驗實驗室檢查的參考資料。
基因測序檢驗實驗室等涉及PCR試劑的相關部分(fēn)應當參照本檢查指南執行。
二、檢查要點
(一)PCR檢驗實驗室布局
生産(chǎn)企業應當提供PCR檢驗實驗室設計方案和/或平面設計圖(應當标明風向或壓差梯度)。
1.PCR檢驗實驗室與PCR試劑生産(chǎn)區(qū)域應當在各自獨立的建築物(wù)或空間内,保證空氣不直接連通,防止擴增時形成的氣溶膠造成交叉污染。
2.原則上PCR檢驗實驗室應當設置以下區(qū)域:試劑儲存和準備區(qū)、标本制備區(qū)、擴增區(qū)、擴增産(chǎn)物(wù)分(fēn)析區(qū)。根據使用(yòng)儀器的功能(néng),區(qū)域可(kě)适當合并。若使用(yòng)實時熒光定量PCR儀且不需要進行後續産(chǎn)物(wù)分(fēn)析工(gōng)作(zuò),擴增區(qū)、擴增産(chǎn)物(wù)分(fēn)析區(qū)可(kě)合并。若使用(yòng)樣本處理(lǐ)、核酸提取及擴增檢測為(wèi)一體(tǐ)的自動化分(fēn)析儀,則标本制備區(qū)、擴增區(qū)、擴增産(chǎn)物(wù)分(fēn)析區(qū)可(kě)合并。合并的區(qū)域需采取相應生物(wù)安(ān)全防護和避免環境污染的措施。
3.各區(qū)域在物(wù)理(lǐ)空間上應當完全相互獨立,各區(qū)域無論是在空間上還是在使用(yòng)中(zhōng),應當始終處于完全的分(fēn)隔狀态。不應當隻是形式上的分(fēn)區(qū),不應當是一個區(qū)域嵌套一個區(qū)域。
4.各區(qū)域不應當有(yǒu)空氣的直接連通。擴增區(qū)與擴增産(chǎn)物(wù)分(fēn)析區(qū)各區(qū)域宜采用(yòng)獨立直排方式出風。采用(yòng)空調機組方式的,PCR檢驗實驗室應當具(jù)備獨立空調機組;同時應當考慮停機後各房間空氣連通的可(kě)能(néng)性,采取必要的控制措施。
5.按照試劑儲存和準備區(qū)→标本制備區(qū)→擴增區(qū)→擴增産(chǎn)物(wù)分(fēn)析區(qū)方向空氣壓力應當以遞減的方式進行,使得PCR檢驗實驗室的空氣流向應當按照試劑儲存和準備區(qū)→标本制備區(qū)→擴增區(qū)→擴增産(chǎn)物(wù)分(fēn)析區(qū)方向進行,防止擴增産(chǎn)物(wù)順空氣氣流進入擴增前的區(qū)域。空氣流向應當為(wèi)單向,禁止下遊污染上遊。應當設置合理(lǐ)的壓差梯度,并安(ān)裝(zhuāng)壓差監測裝(zhuāng)置,以有(yǒu)效證明空氣流向,壓差梯度不宜低于5帕。PCR檢驗實驗室建設可(kě)參考附件進行設計。
6.設置緩沖間的,緩沖間内通向實驗室和走廊的門應當安(ān)裝(zhuāng)互鎖裝(zhuāng)置或采取相應措施,避免出現兩個門同時打開的情況。
7.各區(qū)間若設置傳遞窗,應當為(wèi)雙側開門,要求密封嚴實,并且兩側的門應當為(wèi)互鎖裝(zhuāng)置或采取相應措施确保兩側門不會同時開啓。
(二)儀器設施配置
1.試劑儲存和準備區(qū)的功能(néng):儲存試劑的制備、試劑的分(fēn)裝(zhuāng)和擴增反應混合液的準備,以及離心管、吸頭等消耗品的儲存和準備。配套用(yòng)品一般應當包括:
(1)符合儲存溫度要求的冰箱;
(2)混勻器;
(3)離心機;
(4)水浴箱或加熱模塊;
(5)微量加樣器;
(6)紫外消毒設備;
(7)消耗品:一次性手套、一次性口罩、一次性帽子、耐高壓處理(lǐ)和(或)一次性的離心管和加樣器吸頭;
(8)專用(yòng)工(gōng)作(zuò)服和工(gōng)作(zuò)鞋(套)。
2.标本制備區(qū)的功能(néng):核酸(RNA、DNA)提取、儲存及加樣。配套用(yòng)品一般應當包括:
(1)符合儲存溫度要求的冰箱;
(2)離心機;
(3)混勻器;
(4)水浴箱或加熱模塊;
(5)微量加樣器;
(6)紫外消毒設備;
(7)生物(wù)安(ān)全櫃;
(8)核酸提取設備;
(9)消耗品:一次性手套、一次性口罩、一次性帽子、耐高壓處理(lǐ)和(或)一次性的離心管和加樣器吸頭(帶濾芯);
(10)專用(yòng)工(gōng)作(zuò)服和工(gōng)作(zuò)鞋(套);
(11)如需處理(lǐ)大分(fēn)子DNA,應當具(jù)有(yǒu)超聲波設備。
3.擴增區(qū)的功能(néng):cDNA合成、DNA擴增及檢測。配套用(yòng)品一般應當包括:
(1)核酸擴增設備;
(2)微量加樣器;
(3)離心機;
(4)紫外消毒設備;
(5)消耗品:一次性手套、一次性口罩、一次性帽子、耐高壓處理(lǐ)和(或)一次性的離心管和加樣器吸頭(帶濾芯);
(6)專用(yòng)工(gōng)作(zuò)服和工(gōng)作(zuò)鞋(套)。
4.擴增産(chǎn)物(wù)分(fēn)析區(qū)的功能(néng):擴增片段的進一步分(fēn)析測定。視檢驗方法不同而定,基本配置如下:
(1)分(fēn)析設備;
(2)微量加樣器;
(3)紫外消毒設備;
(4)符合儲存溫度要求的冰箱;
(5)消耗品:一次性手套、一次性口罩、一次性帽子、加樣器吸頭(帶濾芯);
(6)專用(yòng)工(gōng)作(zuò)服和工(gōng)作(zuò)鞋(套)。
上述各區(qū)域儀器設備為(wèi)一般配置,實驗室應當根據使用(yòng)的擴增檢測技(jì )術或試劑的特點,對儀器設備進行必要的增減。
5.設備的維護保養
應當建立設備維護保養規程,計量設備應當定期檢定或校準。例如核酸擴增設備、微量加樣器等應當每年進行檢定或校準工(gōng)作(zuò)。
(三)工(gōng)作(zuò)流程及注意事項
1.單次實驗進入各工(gōng)作(zuò)區(qū)域應當嚴格按照單一方向進行,即試劑儲存和準備區(qū)→标本制備區(qū)→擴增區(qū)→擴增産(chǎn)物(wù)分(fēn)析區(qū)。
2.各工(gōng)作(zuò)區(qū)域必須有(yǒu)明确的标記,不同工(gōng)作(zuò)區(qū)域内的設備、物(wù)品不得混用(yòng)。
3.不同工(gōng)作(zuò)區(qū)域的工(gōng)作(zuò)服應當加以區(qū)分(fēn),不得混用(yòng)(例如可(kě)以采用(yòng)不同顔色)。
4.實驗室的清潔應當按照試劑儲存和準備區(qū)→标本制備區(qū)→擴增區(qū)→擴增産(chǎn)物(wù)分(fēn)析區(qū)的方向進行。不同的實驗區(qū)域應當有(yǒu)其各自的清潔用(yòng)具(jù)并防止交叉污染。實驗垃圾屬于醫(yī)療廢物(wù)的應當按照《醫(yī)療廢物(wù)管理(lǐ)條例》相關規定進行處理(lǐ)。
5.工(gōng)作(zuò)結束後,應當立即對工(gōng)作(zuò)區(qū)進行清潔及消毒。
6.儲存試劑和用(yòng)于标本制備的消耗品等材料應當直接運送至試劑儲存和準備區(qū),不能(néng)經過擴增區(qū)及擴增産(chǎn)物(wù)分(fēn)析區(qū)。應當對加樣吸頭、PCR反應管等消耗品進行防護,防止被污染。使用(yòng)的試劑和耗材不應當對産(chǎn)品檢驗造成幹擾。
7.加入待測核酸時,應采取相應的措施避免樣本間的交叉污染。對具(jù)有(yǒu)潛在傳染危險性的材料,應當在生物(wù)安(ān)全櫃内開蓋,并有(yǒu)明确的樣本處理(lǐ)和滅活程序。
8.如需對擴增産(chǎn)物(wù)進行開蓋處理(lǐ)的,應當采取相應的措施避免氣溶膠所緻的污染。
9.擴增産(chǎn)物(wù)分(fēn)析區(qū)如存在溴化乙錠、丙烯酰胺、甲醛或放射性核素等有(yǒu)毒有(yǒu)害物(wù)質(zhì),應當注意實驗人員的安(ān)全防護,必要時配備通風櫥等防護設備。
(四)人員培訓情況
參與PCR檢驗的工(gōng)作(zuò)人員應當具(jù)備相應的專業知識和技(jì )能(néng),包括能(néng)熟練操作(zuò)相關設備,明确整個工(gōng)作(zuò)的流程,掌握出現污染情況的處理(lǐ)方法以及實驗室質(zhì)量控制方法和檢測結果的解釋。
檢查人員可(kě)以通過詢問或要求人員實際操作(zuò)對其進行評價,也可(kě)以通過查閱人員培訓記錄,對其進行評價。
(五)文(wén)件管理(lǐ)情況
結合實際建立對PCR檢驗實驗室的質(zhì)量管理(lǐ)體(tǐ)系文(wén)件,制定相關程序文(wén)件、操作(zuò)規程等,并保留相應記錄。相關質(zhì)量管理(lǐ)體(tǐ)系文(wén)件包括但不限于實驗室管理(lǐ)制度、人員管理(lǐ)制度、樣本管理(lǐ)制度、實驗室防護管理(lǐ)制度、廢棄物(wù)管理(lǐ)制度等,以及相關設施設備運行與維護操作(zuò)規程、檢驗規程等。
在檢查過程中(zhōng)應當特别注意現場查看、詢問、記錄的實際情況與生産(chǎn)企業的文(wén)件規定、記錄的符合性。
附件:1.理(lǐ)想的PCR檢驗實驗室設計
2.參考資料
附件1
理(lǐ)想的PCR檢驗實驗室設計
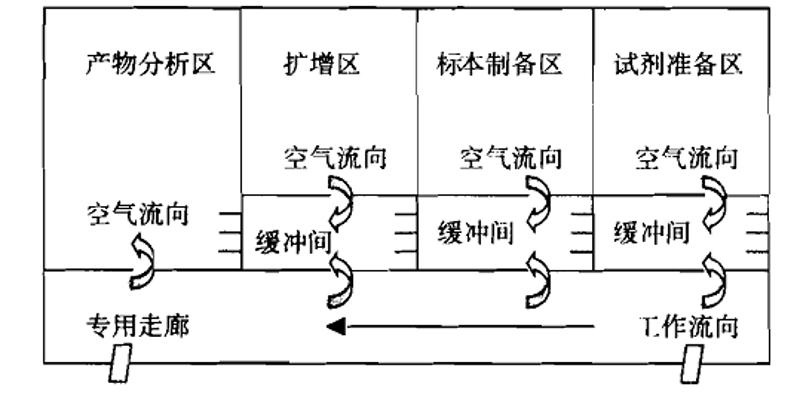
圖A 緩沖間為(wèi)負壓的理(lǐ)想PCR檢驗實驗室設置模式
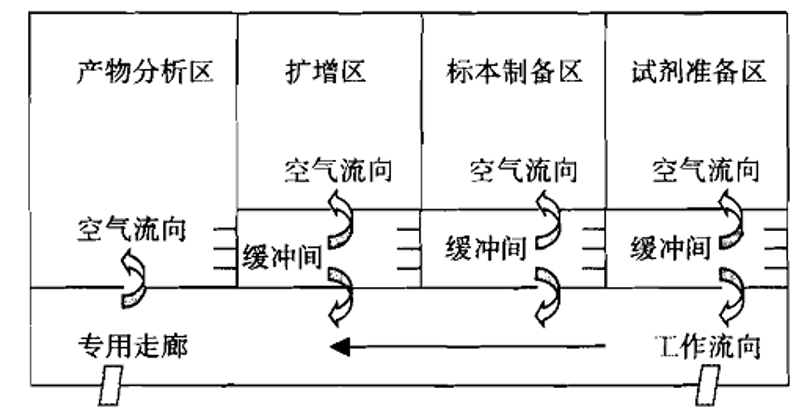
圖B 緩沖間為(wèi)正壓的理(lǐ)想PCR檢驗實驗室設置模式
圖A和圖B所給出的PCR檢驗實驗室設置圖是較為(wèi)理(lǐ)想的設置模式,建議企業參照此種模式設計并建立實驗室。
附件2
參考資料
1.《關于發布醫(yī)療器械生産(chǎn)質(zhì)量管理(lǐ)規範的公(gōng)告》(國(guó)家食品藥品監督管理(lǐ)總局公(gōng)告2014年第64号)
2.《關于發布醫(yī)療器械生産(chǎn)質(zhì)量管理(lǐ)規範附錄體(tǐ)外診斷試劑的公(gōng)告》(國(guó)家食品藥品監督管理(lǐ)總局公(gōng)告2015年第103号)
3.《關于印發醫(yī)療器械生産(chǎn)質(zhì)量管理(lǐ)規範現場檢查指導原則等4個指導原則的通知》(食藥監械監〔2015〕218号)
4.全國(guó)臨床檢驗操作(zuò)規程(第4版)
5.《醫(yī)療機構臨床基因擴增檢驗實驗室管理(lǐ)辦(bàn)法》(衛辦(bàn)醫(yī)政發〔2010〕194号)
6.《實時熒光聚合酶鏈反應 臨 床 實 驗 室應用(yòng)指南》(WS/T 230-2024)
7.《生物(wù)安(ān)全實驗室建築技(jì )術規範》(GB 50346-2011)
8.《實驗室生物(wù)安(ān)全通用(yòng)要求》(GB 19489-2008)
【文(wén)章來源】北京市藥監局
【全文(wén)整理(lǐ)】利恩達
【聲明】部分(fēn)文(wén)章和信息來源于互聯網,不代表本訂閱号贊同其觀點和對其真實性負責。如轉載内容涉及版權等問題,請立即與我們聯系,我們将迅速采取适當措施。
利恩達醫(yī)療專注于醫(yī)療器械領域,專業為(wèi)醫(yī)療器械(含體(tǐ)外診斷試劑)企業提供:産(chǎn)品技(jì )術要求撰寫、産(chǎn)品注冊檢驗、産(chǎn)品臨床試驗、質(zhì)量體(tǐ)系核查、産(chǎn)品注冊證辦(bàn)理(lǐ)、生産(chǎn)許可(kě)證辦(bàn)理(lǐ)、經營許可(kě)證辦(bàn)理(lǐ)、法規咨詢等服務(wù)。在商(shāng)務(wù)服務(wù)-咨詢服務(wù)行業獲得廣大客戶的認可(kě)。
武漢利恩達醫(yī)療科(kē)技(jì )有(yǒu)限公(gōng)司(Wu Han Lienda Med-Tech Co., Ltd),屬于國(guó)家高新(xīn)技(jì )術企業,位于武漢市東湖(hú)高新(xīn)區(qū),專注于醫(yī)療器械和體(tǐ)外診斷試劑領域,有(yǒu)高效專業的服務(wù)團隊,以誠信、專業、高效的理(lǐ)念服務(wù)客戶。
公(gōng)司擁有(yǒu)醫(yī)療器械質(zhì)量管理(lǐ)、質(zhì)量體(tǐ)系監控、臨床數據分(fēn)析等多(duō)個專業性管理(lǐ)平台。公(gōng)司核心人員在醫(yī)療器械和診斷試劑領域從業多(duō)年,擁有(yǒu)豐富的專業知識和從業經驗。
公(gōng)司服務(wù)項目主要包括醫(yī)療器械(含體(tǐ)外診斷試劑)的注冊檢測服務(wù)、注冊申報服務(wù)、臨床試驗服務(wù)、研發體(tǐ)系服務(wù)、質(zhì)量體(tǐ)系服務(wù)、生産(chǎn)許可(kě)證申辦(bàn)服務(wù)、經營許可(kě)證申辦(bàn)服務(wù)等。